Le microalghe rappresentano una promettente fonte di lipidi sostenibili, offrendo vantaggi significativi rispetto alle colture oleaginose terrestri convenzionali grazie alla loro elevata produttività per unità di superficie, alla capacità di crescere su terreni non arabili e all’efficiente utilizzo dei nutrienti (Barbosa et al., 2023).
Un recente studio di Baumgartner et al. (2025) dell’Institute of Food, Nutrition and Health, Sustainable Food Processing Group, ETH Zurich, pubblicato su Food Hydrocolloids, esplora il potenziale delle gocce lipidiche (lipid droplets, LDs) estratte dalla microalga Chlamydomonas reinhardtii come emulsionanti alimentari naturali.
A differenza della produzione tradizionale di olio microalgale, che richiede essiccazione ad alta intensità energetica ed estrazione con solventi organici, l’utilizzo diretto di LDs pre-emulsionate potrebbe offrire un approccio più sostenibile all’utilizzo dei lipidi, evitando al contempo la necessità di processi di ri-emulsificazione.
Metodologia
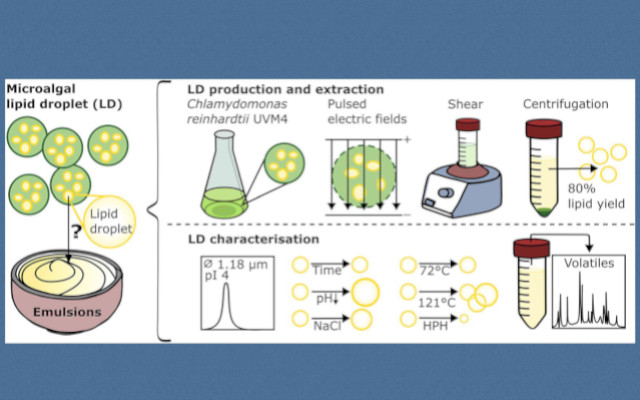
La ricerca ha impiegato il ceppo C. reinhardtii UVM4, privo di parete cellulare e coltivato in condizioni fototrofiche con limitazione di azoto per indurre l’accumulo lipidico. La disgregazione cellulare è stata ottenuta mediante trattamento con campi elettrici pulsati (PEF) con intensità di campo elettrico di 11,8–14,7 kVcm⁻¹ e input energetici volumetrici di 21,9–28,2 kJ L⁻¹ (Baumgartner et al., 2025). Dopo il trattamento PEF, le LDs sono state estratte in ambiente acquoso con integrazione di glucosio al 10% in peso per facilitare la separazione durante la centrifugazione a 3.000×g per 30 minuti. Gli estratti di LD sia grezzi che purificati sono stati caratterizzati mediante analisi granulometrica per diffrazione laser, misurazioni del potenziale ζ, e analisi mediante microscopia ottica e profilo proteico SDS-PAGE.
Lo studio ha valutato sistematicamente la stabilità delle LD in varie condizioni rilevanti per le applicazioni di trasformazione alimentare. La stabilità fisica è stata valutata in intervalli di pH (2–6,5), concentrazioni di cloruro di sodio (0–3,5 M), trattamenti termici (pastorizzazione a 72°C per 21 secondi e sterilizzazione a 121°C per 20 minuti), omogeneizzazione ad alta pressione (110 MPa) e cicli di congelamento-scongelamento. La stabilità chimica è stata esaminata mediante analisi dei composti volatili in spazio di testa per identificare i prodotti di ossidazione, in particolare le aldeidi associate alla degradazione lipidica.
Risultati principali
Il metodo di estrazione acquosa ha raggiunto un impressionante recupero lipidico dell’81 ± 1% in peso, avvicinandosi alle rese riportate per le LDs derivate da semi come colza (90% in peso) e girasole (87% in peso) (Romero-Guzmán et al., 2020; Yang et al., 2023). Gli estratti grezzi di LD contenevano 2,7 ± 0,9 g L⁻¹ di lipidi e 0,26 ± 0,02 g L⁻¹ di proteine, mentre gli estratti purificati erano composti da 96,4 ± 1,0% in peso di lipidi e 3,6 ± 1,0% in peso di proteine. Il profilo proteico ha rivelato una banda prominente tra 25 e 35 kDa, che probabilmente corrisponde alla proteina principale delle gocce lipidiche (MLDP), in linea con i risultati precedenti (Moellering & Benning, 2010; Nguyen et al., 2011). Il diametro medio volumetrico D[4,3] delle LDs grezze era di 1,78 ± 0,08 μm.
I test di stabilità hanno dimostrato che il pH influenza significativamente il comportamento delle LD. Il punto isoelettrico è stato determinato a pH 4, inferiore all’intervallo di pH 5,7–6,6 riportato per le LDs derivate da semi (Tzen et al., 1993). Le LDs coalescevano al loro punto isoelettrico, contrastando con il comportamento delle LDs derivate da semi che rimangono stericamente stabilizzate dalle oleosine anche al loro pI (Tzen & Huang, 1992). Ciò nonostante, le distribuzioni di dimensione delle LD sono rimaste sostanzialmente stabili durante 2–4 settimane di conservazione a 4°C a pH neutro, con solo picchi minori apparsi a 20–40 μm.
Il trattamento termico ha avuto effetti differenziali sull’integrità delle LD. La pastorizzazione (72°C per 21 secondi) ha causato solo lievi aumenti nelle gocce più grandi (3–7 μm), mentre la sterilizzazione (121°C per 20 minuti) ha indotto una pronunciata aggregazione e coalescenza comparabile a quella osservata dopo il congelamento-scongelamento. L’omogeneizzazione ad alta pressione ha ridotto con successo il diametro medio di Sauter D[3,2] da 1,16 ± 0,13 μm a 0,74 ± 0,02 μm (p = 0,0007), indicando che le proteine co-estratte stabilizzavano efficacemente l’area interfacciale aumentata.
Discussione
Lo studio fornisce prove convincenti che la repulsione elettrostatica costituisce il principale meccanismo di stabilizzazione per le LDs di C. reinhardtii, come evidenziato dalla coalescenza dipendente dal pH e dalle misurazioni del potenziale ζ. Il punto isoelettrico più basso rispetto alle LDs derivate da semi presenta un vantaggio pratico, consentendo stabilità attraverso un intervallo di pH più ampio rilevante per i prodotti alimentari acidi. Tuttavia, la coalescenza osservata al pI suggerisce che la stabilizzazione sterica da parte della MLDP possa essere più debole di quella fornita dalle oleosine nelle LDs da semi (Chapman et al., 2012). Questa differenza deriva probabilmente dall’assenza di similarità strutturale tra MLDP e oleosine (Davidi et al., 2012).
Una limitazione critica identificata è stata l’ossidazione lipidica iniziata durante la disgregazione cellulare piuttosto che durante la conservazione. L’analisi dei volatili ha rivelato esanale e altre aldeidi come composti dominanti immediatamente dopo l’estrazione, indicando perossidazione lipidica enzimatica catalizzata da pigmenti, metalli e specie reattive dell’ossigeno rilasciati (Schaich et al., 2012). In particolare, la pastorizzazione ha aumentato significativamente il contenuto di aldeidi (p = 1,15×10⁻¹²), possibilmente a causa della più rapida inattivazione degli inibitori degli enzimi lipolitici rispetto agli enzimi stessi (Prado et al., 2006). Questa instabilità ossidativa pone sfide per la conservazione degli acidi grassi polinsaturi (PUFAs), un vantaggio nutrizionale chiave dei lipidi microalgali.
L’instabilità al congelamento-scongelamento osservata contrasta con la parziale resistenza riportata per le LDs derivate da semi (Nikiforidis et al., 2011), sebbene alcune LDs di C. reinhardtii abbiano mantenuto l’integrità strutturale, suggerendo una copertura eterogenea di proteine interfacciali (Tsai et al., 2015). In analogia, concentrazioni elevate di NaCl (fino a 3,5 M) hanno indotto una coalescenza meno pronunciata rispetto alle alterazioni del pH, indicando che la schermatura delle cariche da sola non è sufficiente a destabilizzare le LDs in modo così efficace quanto le modifiche dirette della carica superficiale.
Valutazione di C. reinhardtii come novel food in UE
La microalga Chlamydomonas reinhardtii (specificamente la polvere di biomassa essiccata del ceppo THN 6) è stata oggetto di richiesta di autorizzazione come novel food nell’Unione Europea, ai sensi del regolamento (UE) 2015/2283:
- il 30 aprile 2025 l’Autorità europea per la sicurezza alimentare (EFSA) ha emesso un parere scientifico ove ha concluso che la sicurezza del novel food non può venire accertata a causa di lacune significative nei dati che riguardano identità, processo produttivo, composizione, storia d’uso, usi proposti, genotossicità e allergenicità;
- il 10 settembre 2025 la Commissione europea ha così adottato una decisione sfavorevole sulla domanda di autorizzazione. Di conseguenza, non è ancora possibile immettere Chlamydomonas reinhardtii sul mercato dell’UE come novel food.
La nostra unità FARE (Food and Agriculture Requirements) di Wiise Benefit supporta imprese e consorzi di ricerca nella progettazione degli studi e nella redazione e presentazione dei dossier per l’autorizzazione dei novel food. L’esperienza maturata nell’analisi normativa sulle microalghe e sulla bioeconomia blu, comprovata dal progetto di ricerca ProFuture, ci consente di offrire un’assistenza solida e altamente specializzata.
Prospettive per l’industria alimentare
La potenziale applicazione delle gocce lipidiche di microalghe come emulsionanti naturali presenta opportunità interessanti per l’industria alimentare, in alternativa agli emulsionanti sintetici quali lecitina, mono- e digliceridi degli acidi grassi e polisorbati. La crescente domanda dei consumatori di prodotti con clean label e alternative vegetali ha intensificato la ricerca di emulsionanti naturali, mantenendo al contempo la stabilità e la funzionalità del prodotto (McClements et al., 2019). Le LDs microalgali potrebbero soddisfare questa esigenza in molteplici applicazioni – tra cui alternative vegetali al latte, condimenti per insalata, maionese e creme spalmabili vegetali – laddove la loro natura pre-emulsionata elimina la necessità di fasi di emulsione aggiuntive o stabilizzanti sintetici.
A differenza degli emulsionanti convenzionali derivati da lecitina di soia o uovo, le LDs di C. reinhardtii non sollevano preoccupazioni di allergenicità. Esse oltretutto beneficiano dello status GRAS in USA e dell’approvazione come novel food in alcune giurisdizioni (Wei, 2022). Inoltre, il valore nutrizionale intrinseco dei lipidi microalgali, in particolare il loro contenuto di acidi grassi polinsaturi, posiziona queste emulsioni naturali come ingredienti funzionali che contribuiscono sia vantaggi tecnologici che salutistici. Per realizzare questo potenziale bisognerà tuttavia affrontare le sfide di stabilità ossidativa e sviluppare metodi di produzione economicamente vantaggiosi in grado di competere con i mercati consolidati degli emulsionanti. La commercializzazione potrebbe perciò concentrarsi dapprima su prodotti di segmento premium, ove le credenziali di sostenibilità e funzionalità nutrizionale possano giustificare i maggiori costi.
Conclusioni
Lo studio in esame dimostra che le gocce lipidiche microalgali di C. reinhardtii rappresentano una piattaforma valida per lo sviluppo di emulsioni naturali prive di additivi con ridotti requisiti di terra e fertilizzanti rispetto alle colture terrestri (Baumgartner et al., 2025). L’estrazione riuscita mediante metodi privi di solventi, combinata con la stabilità durante pastorizzazione e omogeneizzazione, posiziona queste LDs favorevolmente per applicazioni alimentari. L’intervallo di stabilità del pH più ampio rispetto alle LDs derivate da semi offre vantaggi particolari per le formulazioni alimentari acide.
Permangono tuttavia sfide significative, in particolare per quanto attiene alla stabilità ossidativa durante l’estrazione. La ricerca futura dovrebbe attribuire priorità allo sviluppo di strategie di processo volte a sopprimere l’ossidazione enzimatica (Rasor & Duncan, 2014), e alla valutazione quantitativa sistematica dell’ossidazione. Le concentrazioni di LD raggiunte, relativamente basse (2,7 g L⁻¹ di lipidi negli estratti grezzi), richiedono ottimizzazione per applicazioni su scala industriale. Dati i costi di produzione più elevati dei lipidi microalgali rispetto alle alternative derivate da semi (Benvenuti et al., 2017), le applicazioni ad alto valore che includono la fortificazione con PUFA appaiono più promettenti.
I risultati evidenziano differenze fondamentali nei meccanismi di stabilizzazione tra LDs microalgali e da semi, attribuite a proteomi e composizioni glicerolipidiche distinte. Sebbene le LDs di C. reinhardtii manchino della robusta stabilizzazione sterica conferita dalle oleosine, le loro proprietà uniche possono offrire vantaggi in applicazioni specifiche. Ulteriori indagini sulla composizione superficiale delle LD e sulle variazioni specie-specifiche, in particolare nelle microalghe con proteine LD dominanti diverse come Nannochloropsis oceanica (Goold et al., 2015), saranno essenziali per realizzare pienamente il potenziale delle LDs da microalghe come ingredienti sostenibili e funzionali per le industrie alimentare, biotecnologica e cosmetica.
Dario Dongo
Cover image: Baumgartner et al. (2025), graphical abstract
Riferimenti
- Barbosa, M. J., Wijffels, R. H., Janssen, M., Südfeld, C., & Adamo, S. D. (2023). Hypes, hopes, and the way forward for microalgal biotechnology. Trends in Biotechnology, 41(3), 452–471. https://doi.org/10.1016/j.tibtech.2022.12.017
- Baumgartner, J., Arita-Merino, N., Schwager, N., Spahn, D., Ambrosioni, M., Thaler, S., Radiom, M., Boulos, S., Dumpler, J., Fischer, P., & Mathys, A. (2025). The potential of lipid droplets from the microalga Chlamydomonas reinhardtii as natural emulsions. Food Hydrocolloids, 172, 112114. https://doi.org/10.1016/j.foodhyd.2025.112114
- Baumgartner, J., Chua, S. T., Blunier, M., Gao, F., Arita-Merino, N., Abiusi, F., Archer, L., Cybulski, K., Smith, A. G., Studer, M. H., & Mathys, A. (2025). Comparison of lipid droplet extraction from cell wall-deficient Chlamydomonas reinhardtii with pulsed electric fields or osmotic shock. Bioresource Technology, 434, 132764. https://doi.org/10.1016/j.biortech.2025.132764
- Benvenuti, G., Ruiz, J., Lamers, P. P., Bosma, R., Wijffels, R. H., & Barbosa, M. J. (2017). Towards microalgal triglycerides in the commodity markets. Biotechnology for Biofuels, 10(1), 188. https://doi.org/10.1186/s13068-017-0873-2
- Chapman, K. D., Dyer, J. M., & Mullen, R. T. (2012). Biogenesis and functions of lipid droplets in plants: Thematic review series: Lipid droplet synthesis and metabolism: From yeast to man. Journal of Lipid Research, 53(2), 215–226. https://doi.org/10.1194/jlr.R021436
- Davidi, L., Katz, A., & Pick, U. (2012). Characterization of major lipid droplet proteins from Dunaliella. Planta, 236(1), 19–33. https://doi.org/10.1007/s00425-011-1585-7
- European Commission. (2025, September 10). Commission Implementing Decision terminating the procedure for authorisation of dried biomass powder of Chlamydomonas reinhardtii THN 6 as a novel food without updating the Union list of novel foods (C(2025) 5980 final).
- European Food Safety Authority. (2025, April 30). Safety of dried biomass powder of Chlamydomonas reinhardtii THN 6 as a novel food pursuant to Regulation (EU) 2015/2283. EFSA Journal, 23(4), e9413. https://doi.org/10.2903/j.efsa.2025.9413
- Goold, H., Beisson, F., Peltier, G., & Li-Beisson, Y. (2015). Microalgal lipid droplets: Composition, diversity, biogenesis and functions. Plant Cell Reports, 34(4), 545–555. https://doi.org/10.1007/s00299-014-1711-7
- McClements, D. J., Newman, E., & McClements, I. F. (2019). Plant-based milks: A review of the science underpinning their design, fabrication, and performance. Comprehensive Reviews in Food Science and Food Safety, 18(6), 2047–2067. https://doi.org/10.1111/1541-4337.12505
- Moellering, E. R., & Benning, C. (2010). RNA interference silencing of a major lipid droplet protein affects lipid droplet size in Chlamydomonas reinhardtii. Eukaryotic Cell, 9(1), 97–106. https://doi.org/10.1128/EC.00203-09
- Nguyen, H. M., Baudet, M., Cuiné, S., Adriano, J. M., Barthe, D., Billon, E., Bruley, C., Beisson, F., Peltier, G., Ferro, M., & Li-Beisson, Y. (2011). Proteomic profiling of oil bodies isolated from the unicellular green microalga Chlamydomonas reinhardtii: With focus on proteins involved in lipid metabolism. Proteomics, 11(21), 4266–4273. https://doi.org/10.1002/pmic.201100114
- Nikiforidis, C. V., Karkani, O. A., & Kiosseoglou, V. (2011). Exploitation of maize germ for the preparation of a stable oil-body nanoemulsion using a combined aqueous extraction-ultrafiltration method. Food Hydrocolloids, 25(5), 1122–1127. https://doi.org/10.1016/j.foodhyd.2010.10.009
- Prado, B. M., Sombers, S. E., Ismail, B., & Hayes, K. D. (2006). Effect of heat treatment on the activity of inhibitors of plasmin and plasminogen activators in milk. International Dairy Journal, 16(6), 593–599. https://doi.org/10.1016/j.idairyj.2005.09.018
- Rasor, A. S., & Duncan, S. E. (2014). Fats and oils – Plant based. In S. Clark, S. Jung, & B. Lamsal (Eds.), Food processing: Principles and applications (2nd ed., pp. 457–480). John Wiley & Sons.
- Romero-Guzmán, M. J., Jung, L., Kyriakopoulou, K., Boom, R. M., & Nikiforidis, C. V. (2020). Efficient single-step rapeseed oleosome extraction using twin-screw press. Journal of Food Engineering, 276, 109890. https://doi.org/10.1016/j.jfoodeng.2019.109890
- Schaich, K. M., Shahidi, F., Zhong, Y., & Eskin, N. A. M. (2012). Lipid oxidation. In N. A. M. Eskin, & F. Shahidi (Eds.), Biochemistry of foods (pp. 419–469). Academic Press Elsevier.
- Tsai, C. H., Zienkiewicz, K., Amstutz, C. L., Brink, B. G., Warakanont, J., Roston, R., & Benning, C. (2015). Dynamics of protein and polar lipid recruitment during lipid droplet assembly in Chlamydomonas reinhardtii. The Plant Journal, 83(4), 650–660. https://doi.org/10.1111/tpj.12917
- Tzen, J. T. C., Cao, Y. Z., Laurent, P., Ratnayake, C., & Huang, A. H. C. (1993). Lipids, proteins, and structure of seed oil bodies from diverse species. Plant Physiology, 101(1), 267–276. https://doi.org/10.1104/pp.101.1.267
- Tzen, J. T. C., & Huang, A. H. C. (1992). Surface structure and properties of plant seed oil bodies. Journal of Cell Biology, 117(2), 327–335. https://doi.org/10.1083/jcb.117.2.327
- Wei, S. (2022). NHC approved 3 new food raw materials and 18 new food additives in China. CIRS. Retrieved from https://www.cirs-group.com/en/food/nhc-approved-3-new-food-raw-materials-and-18-new-food-additives-in-china
- Yang, J., Vardar, U. S., Boom, R. M., Bitter, J. H., & Nikiforidis, C. V. (2023). Extraction of oleosome and protein mixtures from sunflower seeds. Food Hydrocolloids, 145, 109078. https://doi.org/10.1016/j.foodhyd.2023.109078
Dario Dongo, lawyer and journalist, PhD in international food law, founder of WIISE (FARE - GIFT - Food Times) and Égalité.